Bảng tuần hoàn các nguyên tố hóa học và ý nghĩa | friend.com.vn
Phần kiến thức về bảng tuần hoàn nguyên tố hóa học vô cùng cần thiết đối với các bạn học sinh trong quá trình học tập môn hóa học, nhất là đối với các bạn học sinh học khối tự nhiên. Bài viết dưới đây nhằm giúp các bạn có thể dễ dàng hiểu được tất cả các phần thông tin kiến thức của bảng này.
Mục lục bài viết
- Nguồn gốc về khái niệm bảng tuần hoàn hóa học
- Các nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn hóa học
- 1. Sắp xếp các nguyên tố theo nhóm
- 2. Sắp xếp các nguyên tố theo chu kỳ
- 3. Sắp xếp theo phân nhóm
- 4. Một số cách sắp xếp khác
- Cấu tạo chi tiết và cách đọc bảng tuần hoàn nguyên tố hóa học
- 1. Ô nguyên tố
- a. Tên nguyên tố
- b. Ký hiệu hóa học
- c. Số hiệu nguyên tử
- d. Nguyên tử khối trung bình
- e. Độ âm điện
- f. Cấu hình electron
- g. Số oxi hóa
- 2. Chu kỳ
- a. Định nghĩa
- b. Phân loại chu kỳ
- c. Tính chất chu kỳ
- 3. Nhóm (nguyên tố)
- a. Định nghĩa
- b. Phân loại nhóm nguyên tố
- c. Nhận xét:
- 1. Ô nguyên tố
- Ý nghĩa bảng tuần hoàn hóa học của Mendeleev
- Một số cách ghi nhớ bảng tuần hoàn hóa học hiệu quả
- 1. Nghiên cứu chi tiết các phần trong bảng tuần hoàn hóa học
- 2. In ra và dán ở những nơi thường xuyên thấy
- 3. Làm nhiều các bài tập liên quan
- 4. Chia nhóm và sử dụng các mẹo ghi nhớ nhanh
Nguồn gốc về khái niệm bảng tuần hoàn hóa học
Bảng tuần hoàn hóa học hay còn được biết đến là bảng tuần hoàn Mendeleev là viết tắt của bảng tuần hoàn các nguyên tố hóa học. Bảng này biểu thị các nguyên tố hóa học dựa theo cách sắp xếp số hiệu nguyên tử của các nguyên tố (số proton), cấu hình electron và các quy luật tuần hoàn khác của chúng.

Bảng tuần hoàn hóa học được phát minh bởi Dimitri Mendeleev và được phát hành ra sử dụng rộng rãi lần đầu tiên vào năm 1869. Từ đó trở về sau, bảng tuần hoàn này được công chúng đón nhận và trở thành một tài liệu quan trọng cho các công trình khoa học. Nhờ vào bảng tuần hoàn hóa học này, con người ngày nay có thể dễ dàng hiểu về sự vận hành của các nguyên tố và các quy luật khác trong khoa học.
Bảng tuần hoàn hóa học được sử dụng trong thời điểm hiện nay đã được chỉnh sửa và mở rộng thêm vì sự phát hiện các nguyên tố mới khác. Tuy nhiên, về mặt hình thức thì bảng tuần hoàn các nguyên tố hóa học hiện tại vẫn giữ được đúng những nét cơ bản của bảng tuần hoàn gốc của Mendeleev.
Các nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn các nguyên tố hóa học, các nguyên tố được sắp xếp theo một trật tự nhất định theo các nguyên tắc sau:
1. Sắp xếp các nguyên tố theo nhóm
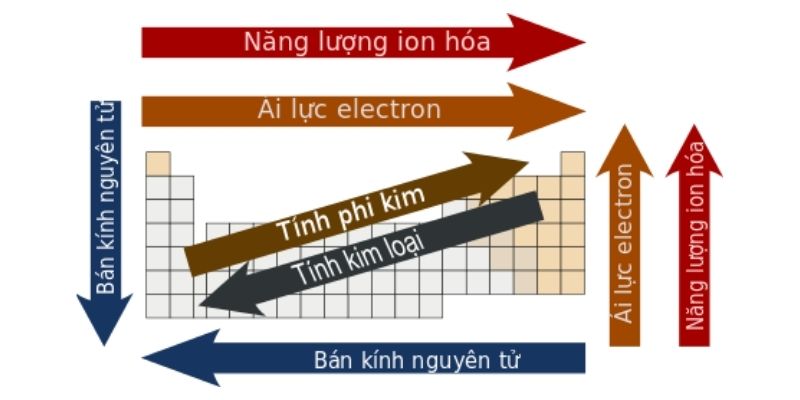
Nhóm (hoặc họ) là một cột trong bảng tuần hoàn các nguyên tố hóa học. Các nguyên tố xếp chung một nhóm sẽ có cấu hình electron như nhau trong lớp hóa trị và do đó các nguyên tố này sẽ có tính chất hóa học tương tự nhau. Trong một nhóm, số hiệu nguyên tử và bán kính của các nguyên tố sẽ tăng dần từ trên xuống dưới. Do đó, mức năng lượng của các nguyên tử sẽ được lấp đầy hơn, các electron ngoài cùng cũng sẽ cách xa hạt nhân hơn.
Đồng thời, xét từ trên xuống dưới, mức năng lượng ion hóa của các nguyên tử sẽ giảm dần, hay các electron phía ngoài sẽ dễ dàng bị tách ra khỏi nguyên tử hơn. Tương tự, trong một nhóm, nguyên tử có số hiệu nguyên tử càng lớn thì độ âm điện càng giảm (loại trừ cho trường hợp nhóm 11).
2. Sắp xếp các nguyên tố theo chu kỳ
Các nguyên tố được sắp theo chu kỳ nghĩa là được sắp xếp thành một hàng ngang trong bảng tuần hoàn. Theo chiều từ trái sang phải, bán kính nguyên tử của nguyên tố sẽ giảm dần còn độ âm điện và năng lượng ion hóa sẽ tăng dần do sự tăng dần của số proton trong hạt nhân sẽ làm cho e lớp ngoài cùng được kéo lại gần hơn

3. Sắp xếp theo phân nhóm
Có thể xếp các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học vào 4 phân nhóm khác nhau là s, p, d và f. Theo IUPAC, electron cuối cùng của nguyên tử nguyên tố được điền vào phân lớp nào (theo trình tự mức năng lượng) thì nguyên tố đó sẽ thuộc phân nhóm đó.
4. Một số cách sắp xếp khác
Ngoài ba cách sắp xếp các nguyên tố như trên, người ta có thể chia các nguyên tố trong bảng tuần hoàn hóa học thành 3 loại là á kim ,kim loại và phi kim.
Kim loại là các chất rắn, có ánh kim, có khả năng dẫn nhiệt và dẫn điện tốt. Các kim loại này có thể kết hợp với nhau hoặc kết hợp với phi kim tạo thành hợp chất. Và trong bảng tuần hoàn hóa học, kim loại thường hay được phân bổ ở phía bên trái và bên dưới.
Ngược lại, phi kim thường là các chất khí có màu hoặc không màu, không có khả năng dẫn nhiệt hay dẫn điện. Phi kim thường kết hợp với nhau để tạo thành hợp chất hóa trị, và thường được xếp nằm phía bên phải và phía bên trên của bảng tuần hoàn.
Còn lại, ở giữa kim loại và phi kim chính là các á kim. Các nguyên tố này thường sẽ có tính chất trung gian giữa kim loại và phi kim.
Cấu tạo chi tiết và cách đọc bảng tuần hoàn nguyên tố hóa học
Tại thời điểm bây giờ, so với phiên bản 113 nguyên tố hóa học. IUPAC đã tiến hành đưa thêm 3 nguyên tố khác chính thức trở thành thành thành phần chính của bảng tuần hoàn. Các nguyên tố mới có số hiệu nguyên tử là 115, 117, 118. Như vậy, cùng với nguyên tố 114 và 116, bảng tuần hóa các nguyên tố hóa học hiện tại có 1 chu kỳ 7 tương đối hoàn chỉnh. Khi nhìn vào một bảng tuần hoàn hóa học, sẽ có các phần chính được thể hiện như sau:
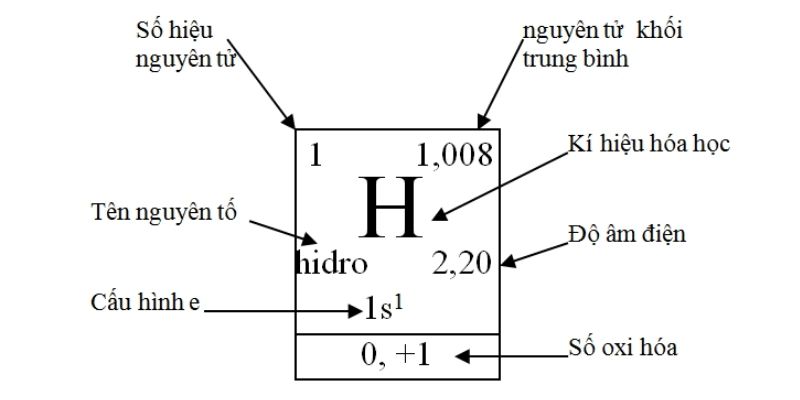
1. Ô nguyên tố
Các nguyên tố trong bảng tuần hoàn hóa học được biểu diễn hết sức cụ thể và chi tiết thành các ô như hình bên dưới.Mỗi ô gồm các thành phần thông tin như sau:
a. Tên nguyên tố
Tên nguyên tố tức là tên của nguyên tố hóa học được viết theo từ vựng cổ điển của tiếng Latin và Hy Lạp. Các nguyên tố này được phân biệt với nhau bằng số hiệu nguyên tử hoặc số proton có trong hạt nhân của mỗi nguyên tử nguyên tố đó.
b. Ký hiệu hóa học
Ký hiệu hóa học chính là viết tắt tên của của một nguyên tố. Thông thường ký hiệu hóa học sẽ gồm có từ một đến hai chữ cái trong bảng chữ cái Latin. Chữ cái đầu tiên của ký hiệu hóa học sẽ là chữ cái viết hoa, còn chữ cái còn lại sẽ được viết thường.

c. Số hiệu nguyên tử
Số hiệu nguyên tử cho biết số proton của một nguyên tố có trong trong hạt nhân của một nguyên tử. Số này cũng chính là số điện tích hạt nhân (điện tích dương) của nguyên tử nguyên tố đó. Vì số hiệu nguyên tử của một nguyên tố là duy nhất nên dựa vào số này, bạn có thể dễ dàng xác định được tên của nguyên tố cần tìm. Ngoài ram khi một nguyên tử không tích điện, thì số electron của lớp vỏ sẽ bằng với số hiệu nguyên tử.
Lưu ý: Số thứ tự ô nguyên tố = số hiệu nguyên tử ( số e= số p= số điện tích hạt nhân)
d. Nguyên tử khối trung bình
Nguyên tử khối trung bình là khối lượng trung bình của hỗn hợp các đồng vị của nguyên tố đó theo một tỷ lệ phần trăm các nguyên tử nhất định.
e. Độ âm điện
Độ âm điện của một nguyên tử nguyên tố hóa học là khả năng hút electron của nguyên tử nguyên tố đó để tạo các liên kết hóa học. Do đó, khi độ âm điện của nguyên tử nguyên tố đó càng lớn thì tính phi kim sẽ càng mạnh và ngược lại, nếu độ âm điện của nguyên tử càng nhỏ thì tính phi kim sẽ nhỏ hay tính kim loại sẽ mạnh.
f. Cấu hình electron
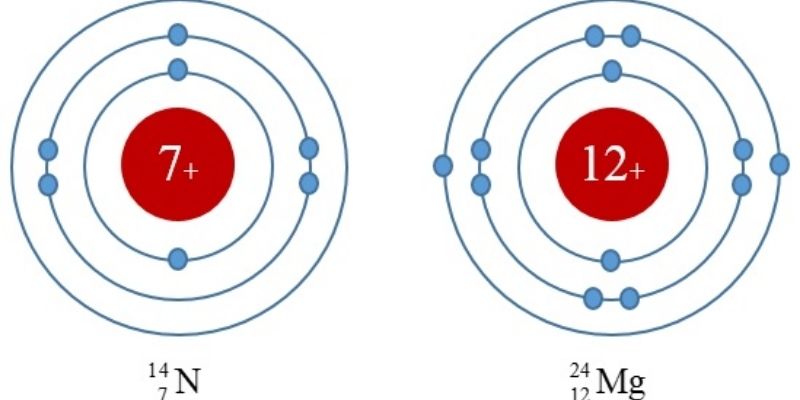
Cấu hình electron hay còn gọi là cấu hình điện tử, nguyên tử thể hiện sự phân bố các electron có trong lớp vỏ nguyên tử nguyên tố đó ở những trạng thái năng lượng khác nhau.
g. Số oxi hóa
Số oxi hóa cho biết số electron mà một hay nhiều nguyên tử nguyên tố sẽ trao đổi với nguyên tử nguyên tố khác khi tham gia vào một phản ứng oxi hóa khử.
2. Chu kỳ
a. Định nghĩa
Chu kỳ là một dãy các nguyên tố hóa học mà nguyên tử nguyên tố đó có cùng số lớp e được sắp xếp theo chiều tăng dần điện tích hạt nhân.
b. Phân loại chu kỳ
Hiện tại bảng tuần hoàn nguyên tố hóa học gồm có 7 chu kỳ:
Chu kỳ 1, 2 và 3 được gọi là chu kỳ nhỏ.
Chu kỳ 4,5,6 và 7 được gọi là chu kỳ lớn. Trong đó, chu kỳ 7 vẫn chưa được hoàn thiện.

Trong đó:
Chu kỳ 1: có 2 nguyên tố là Hidro ( Z=1) và Heli (Z=2).
Chu kỳ 2: có 8 nguyên tố từ Liti (Z=3) đến Neon (Z=10).
Chu kỳ 3: có 8 nguyên tố từ Natri (Z=11) đến Argon (Z=18).
Chu kỳ 4: có 18 nguyên tố từ Kali (Z=19) đến Krypton (Z=36).
Chu kỳ 5: có 18 nguyên tố từ Rubidi (Z=37) đến Xenon (Z=54).
Chu kỳ 6: có 32 nguyên tố từ Xesi (Z=55) đến Ranon (Z=86).
Chu kỳ 7: bắt đầu từ nguyên tố Franxi (Z=87) đến nguyên tố Z=110.
c. Tính chất chu kỳ
- Trong bảng tuần hoàn hóa học, các nguyên tố cùng một một chu kỳ sẽ có số lớp electron bằng nhau và bằng số thứ tự chu kỳ.
- Một chu kỳ sẽ bắt đầu từ một kim loại kiềm và kết thúc bằng một nguyên tố khí hiếm.
- Hai hàng cuối của bảng tuần hoàn hóa học là hai họ nguyên tố có cấu hình e đặc biệt là : họ Latan gồm 14 nguyên tố thuộc chu kỳ 6 và họ Actini gồm 14 nguyên tố thuộc chu kỳ 7.
3. Nhóm (nguyên tố)
a. Định nghĩa
Nhóm nguyên tố hay còn được viết tắt là nhóm, là tập hợp tất cả các nguyên tố mà nguyên tử của nó có cấu hình electron tương tự như nhau, do vậy tính chất hóa học của chúng cũng gần như giống nhau. Các nguyên tố như vậy sẽ được xếp thành một cột, và được gọi chung là một nhóm.
b. Phân loại nhóm nguyên tố
Bảng tuần hoàn hóa học được chia thành 8 nhóm A và 8 nhóm B (riêng nhóm VIIIB gồm 3 cột).
Nhóm A: gồm nguyên tố nhóm s và nguyên tố nhóm p. Các nguyên tố của nhóm này có số tự nhóm bằng với số lớp e ngoài cùng.
Nhóm B: gồm các nguyên tố nhóm d và nhóm f. Các nguyên tử nguyên tố của các nhóm này thông thường sẽ có cấu hình e ngoài cùng ở dạng (n-1)dxnsy . Khi đó, cách xác định nhóm của các nguyên tố này sẽ được thực hiện như sau:
- + Trường hợp 1: Tổng (x+y) có giá trị từ 3 đến 7 thì nguyên tử nguyên tố này sẽ thuộc nhóm (x+y)B.
- + Trường hợp 2: Tổng (x+y) có giá trị từ 8 đến 10 thì nguyên tử nguyên tố sẽ thuộc nhóm VIIIB.
- + Trường hợp 3: Tổng (x+y) có giá trị lớn hơn 10 thì nguyên tử nguyên tố đó sẽ thuộc nhóm (x+y-10)B.
Các nguyên tố s, p, d, f trong bảng tuần hoàn nguyên tố hóa học:
Nguyên tố s: bao gồm những nguyên tố nhóm IA và IIA. Các nguyên tử nguyên tố s sẽ có electron cuối cùng được điền vào phân nhóm s.
Nguyên tố p: bao gồm những nguyên tố nhóm IIIA đến nhóm VIIIA ( loại trừ Heli). Electron cuối cùng của nguyên tử nguyên tố p sẽ được phân bổ vào phân nhóm p.
Nguyên tố d: là các nguyên tố thuộc nhóm B có electron cuối cùng được điền vào phân nhóm d.
Nguyên tố f: là các nguyên tố thuộc họ Lantan và Actini. Tương tự như các nguyên tố trên, nguyên tố f có electron cuối cùng được điền vào phân nhóm f.
c. Nhận xét:
Nguyên tử của các nguyên tố cùng nhóm sẽ có cùng số electron hóa trị và số thứ tự nhóm (trừ 2 nhóm VIIIB cuối cùng của bảng tuần hoàn)
Ý nghĩa bảng tuần hoàn hóa học của Mendeleev
Khi xác định được vị trí một nguyên tố, trong bảng tuần hoàn hóa học,chúng ta có thể dễ dàng xác định các thông tin sau:

- Thông thường, các nguyên tố nhóm IA, IIA và IIIA (trừ Bo và Hidro) thì có tính kim loại. Trong khi đó, nhóm VA, VIA và VIIA sẽ có tính phi kim (loại trừ Antimon, Bitmut và Poloni).
- Khi xác định được vị trí nguyên tố có thể xác định được hóa trị cao nhất của nguyên tố đó với Oxi và Hidro.
- Có thể xác định được công thức oxit cao nhất và hidroxit tương ứng.
- Công thức hợp chất với Hidro,…
Ví dụ: Lưu huỳnh (S) ở vị trí ô số 16 trong bảng tuần hoàn hóa học nên:
- Lưu huỳnh thuộc nhóm VI, chu kỳ 3 và là phi kim.
- Hóa trị cao nhất khi kết hợp với Oxi là 6 và với Hidro là 2.
- Công thức Oxit cao nhất của Lưu huỳnh là SO3 và hợp chất với Hidro là H2S.
- SO3 là một Oxit axit và axit tương ứng của nó là H2SO4 là một axit mạnh.
Để xác định được các thông tin trên, ta có thể căn cứ vào các mối quan hệ giữa:
- Vị trí của nguyên tố và đặc điểm về cấu tạo nguyên tử
- Vị trí của nguyên tố và tính chất của nó
Ngoài ra, khi xác định được vị trí của một nguyên tố, căn cứ vào các quy luật trong chu kỳ và nhóm, có thể tiến hành so sánh các tính chất hóa học của nguyên tố đó với các nguyên tố lân cận.
Một số cách ghi nhớ bảng tuần hoàn hóa học hiệu quả
Bảng tuần hoàn các nguyên tố hóa học là một kiến thức quan trọng, do đó các bạn nên học tập thật tốt phần kiến thức này bằng các cách sau đây:

1. Nghiên cứu chi tiết các phần trong bảng tuần hoàn hóa học
Đây là một cách học ngấm dần và giúp cho bạn nhớ lâu các thông tin bằng cách lần lượt học các thành phần của một nguyên tố trong bảng. Bạn có thể sắp xếp một ngày học từ 5 đến 10 nguyên tố, dần dần bạn sẽ học hết tất cả các nguyên tố có trong bảng.
2. In ra và dán ở những nơi thường xuyên thấy
Để có thể thường xuyên nhìn thấy các thông tin về các nguyên tố trong bảng, bạn có thể in bảng tuần hoàn các nguyên tố hóa học ra và dán ở một nơi mà bạn thường lui tới.
3. Làm nhiều các bài tập liên quan
Làm bài tập là một cách làm hữu hiệu giúp bạn nhớ nhanh và lâu các thông tin về bảng tuần hoàn vì cách này yêu cầu bạn cần phải thực hành nhiều lần và vận dụng đầu óc để suy nghĩ.

4. Chia nhóm và sử dụng các mẹo ghi nhớ nhanh
Trong trường hợp nếu mà bạn cần hoặc mong muốn phải ghi nhớ gấp các thông tin về bảng tuần hoàn, các bạn có thể chia nhỏ các nguyên tố thành các nhóm và đặt tên các nguyên tố đó thành các cụm sao cho dễ nhớ nhất, sau đó học thuộc lòng. Nếu các bạn sợ tốn thời gian, các bạn có thể tham khảo các cách sắp xếp hiện có trên mạng Internet như:
Nhóm IA: Hai (H), Li (Li), Nào (Na), Không (K), Rót (Rb), Cà (Cs), Fê (Fr).
Nhóm IIA: Banh (Be), Miệng (Mg), Cá (Ca), Sấu (Sr), Bẻ (Ba), Răng (Ra).
Nhóm IIIA: Bố (B), Ai (Al), Gáy (Ga), Inh (In), Tai (Ti).
Nhóm IV: Chú (C), Sỉ (Si), Gọi em (Ge), Sang nhắm (Sn), Phở bò (Pb).
Nhóm V: Nhà (N), Phương (P), Ăn (As), Sống (Sb), Bí (Bi).
Nhóm VI: Ông (O), Say (S), Sỉn (Se), Té (Te), Pò (Po).
Nhóm VII: Phải (F), Chi (Cl), Bé (Br), Yêu (I), Anh (At).
Nhóm VIII: Hằng (He), Nga (Ne), Ăn (Ar), Khúc (Kr), Xương (Xe), Rồng (Rn).
Với những thông tin mà friend.com.vn chia sẻ ở trên, hi vọng rằng các bạn sẽ có thể nắm rõ các kiến thức cần thiết liên quan đến bảng tuần hoàn các nguyên tố hóa học.
- Share CrocoBlock key trọn đời Download Crocoblock Free
- Cung cấp tài khoản nghe nhạc đỉnh cao Tidal Hifi – chất lượng âm thanh Master cho anh em mê nhạc.
- Chia sẻ 8 website tạo logo miễn phí tốt nhất Thủ thuật,Ứng dụng
- Những tweak không thể thiếu cho iOS 8.4 – Đức
- Chia sẻ tài khoản apple store mới nhất 2021, share id apple 2021 free – Phucoday
- Hướng dẫn cách chặn số lạ trên iPhone cực đơn giản
- Những hình ảnh lá cờ Việt Nam tuyệt đẹp
Bài viết cùng chủ đề:
-
Ổ cứng bị Unallocated là bị gì và cách khôi phục dữ liệu hiệu quả
-
Hướng dẫn đăng ký bán hàng trên Now – Foody nhanh nhất
-
Tổng hợp những ứng dụng kiểm tra mã vạch chính xác nhất cho iPhone
-
Cách chuyển dữ liệu từ máy tính sang Android – Download.vn
-
Tổng hợp khuyến mãi dung lượng Viettel – Data 4G Viettel cập nhật nhanh nhất – Khuyến mãi – Thuvienmuasam.com
-
Cách chuyển Google Chrome sang tiếng Việt – QuanTriMang.com
-
Nên mua iphone 6 plus hay 6s plus? – SOshop
-
7 cách tắt màn hình laptop Windows 10 – QuanTriMang.com
-
Cách gõ tiếng Việt có dấu bằng kiểu VNI, Telex trên điện thoại Android – Thegioididong.com
-
Cách chơi Vainglory trên PC bằng giả lập android BlueStacks
-
Cảnh nóng gây sốc bị chỉ trích nặng nề nhất trong phim gây nghẽn sóng HBO
-
Hướng dẫn biến thẻ nhớ thành bộ nhớ trong cho điện thoại Android – Fptshop.com.vn
-
Need for Speed: Hot Pursuit PC Free Download Full Version – Gaming Beasts
-
Tăng Follow Instagram Miễn Phí 2021 ❤️ Cách Free Hay Nhất
-
3 cách làm ông già Noel bằng giấy cực đơn giản – QuanTriMang.com
-
Cách cài Kali Linux trên VMware cực dễ, có GUI – QuanTriMang.com



